

2020年4月16日,药时代直播间有幸邀请到博济医药首席科学家(医药器械方向)、九泰药械总经理、医疗器械临床研究资深专家李强先生为我们解读“医疗器械注册和临床试验关键点分析”。本次直播的参与人次已破800,而回看的人次也正不断地增加。可见朋友们对这次直播的关注度非常高。再次感谢李强意大利贵宾会italycasino先生在百忙之中为我们带来专业解读和精彩演讲。
为了方便朋友们快速了解演讲中的重点,药时代对其内容进行了编辑,意大利贵宾会italycasino并分享了直播中所用的PPT。您可点击阅读原文,回听本次直播。
意大利贵宾会italycasino医疗器械临床试验方案设计及实施
意大利贵宾会italycasino如何与机构办、伦理、研究者进行有效沟通
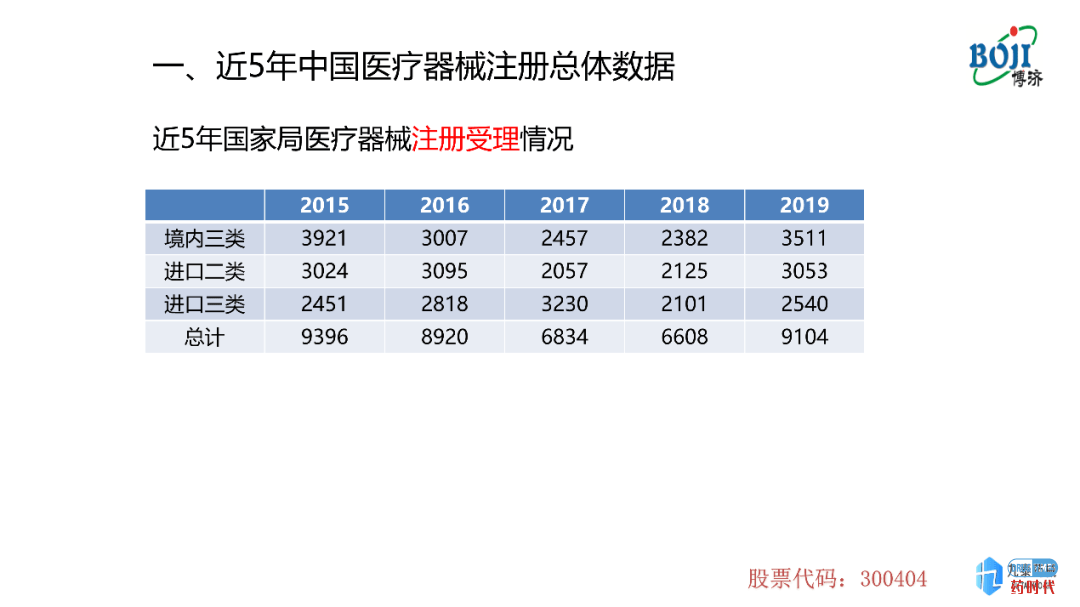
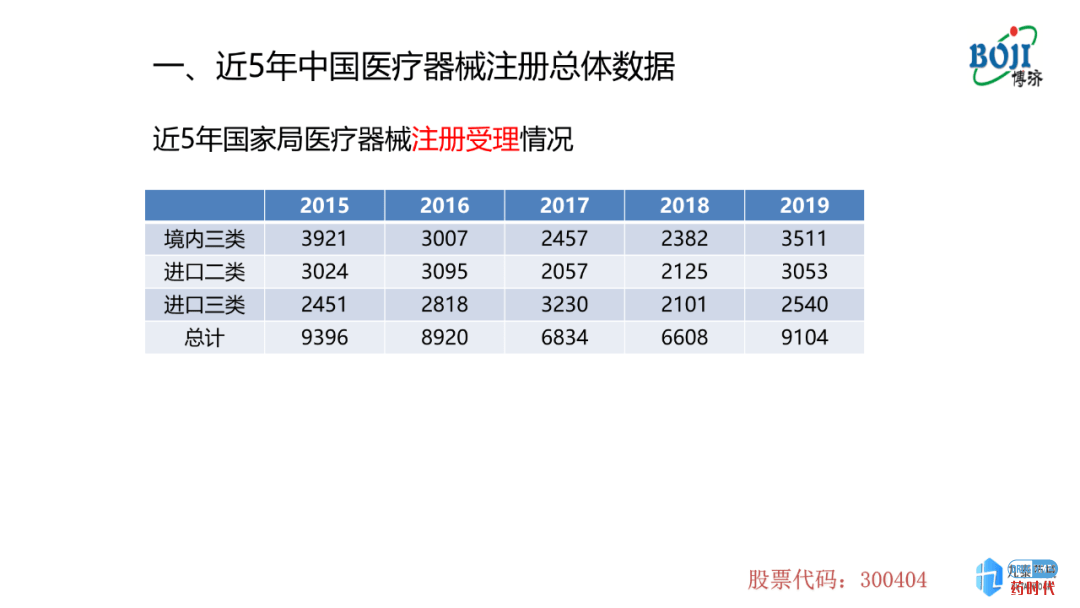
图表1为近5年国家局注册受理的情况,从图中可以出,在2015-2018年内,境内三类、进口二类和进口三类整体受理数量在下降,但是到了2019年数量有所上升,这其中包含首次注册及延续注册。为什么会出现这样一个现象呢?
2014年,国家颁布了《医疗器械监督管理条例》,该管理条例颁布之后,国家药监局对医疗器械的注册、审评、审批以及对临床试验质量核查的尺度不断地加严,并颁布了一系列的注册法规、技术文件等,导致注册受理的数量减少。2019年数据上升可能是由延续注册引起的意大利贵宾会italycasino(医疗器械需要延续注册,周期大约为5年/次)。但数据上升并不仅仅是因为这个原因。
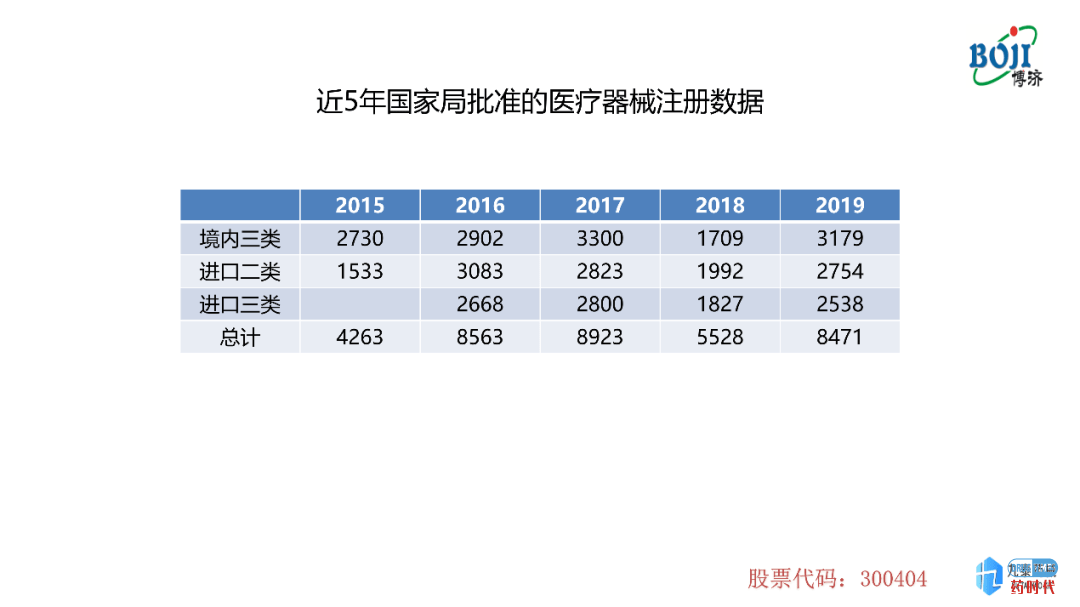
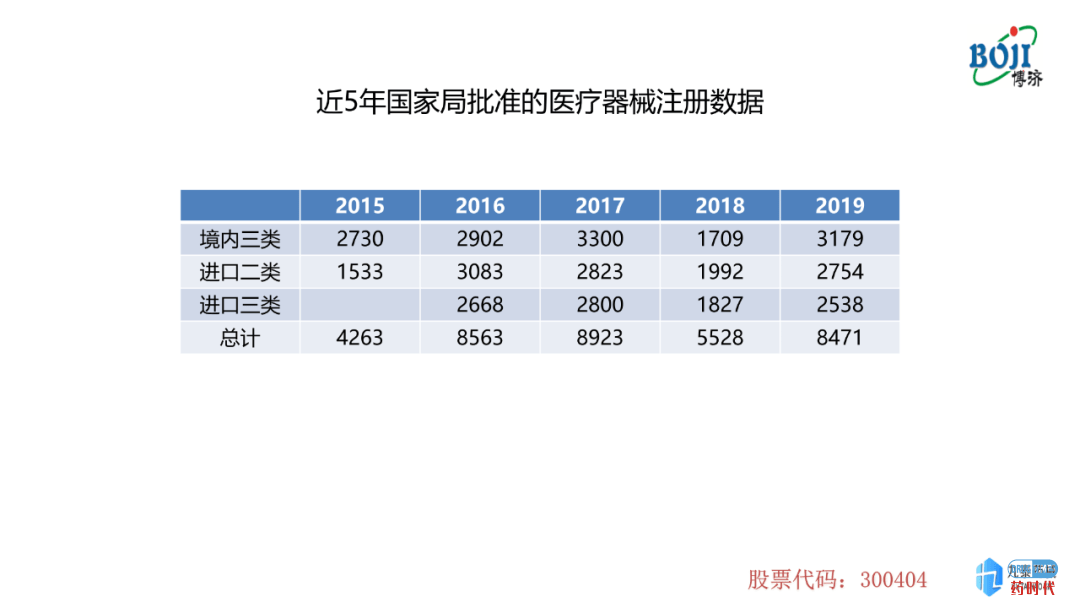
图表2是近5年国家局批准的医疗器械注册的数据,本表中批准的注册数据也包含首次注册及延续注册两大类,数量趋势与图表1中的趋势是基本一样的。
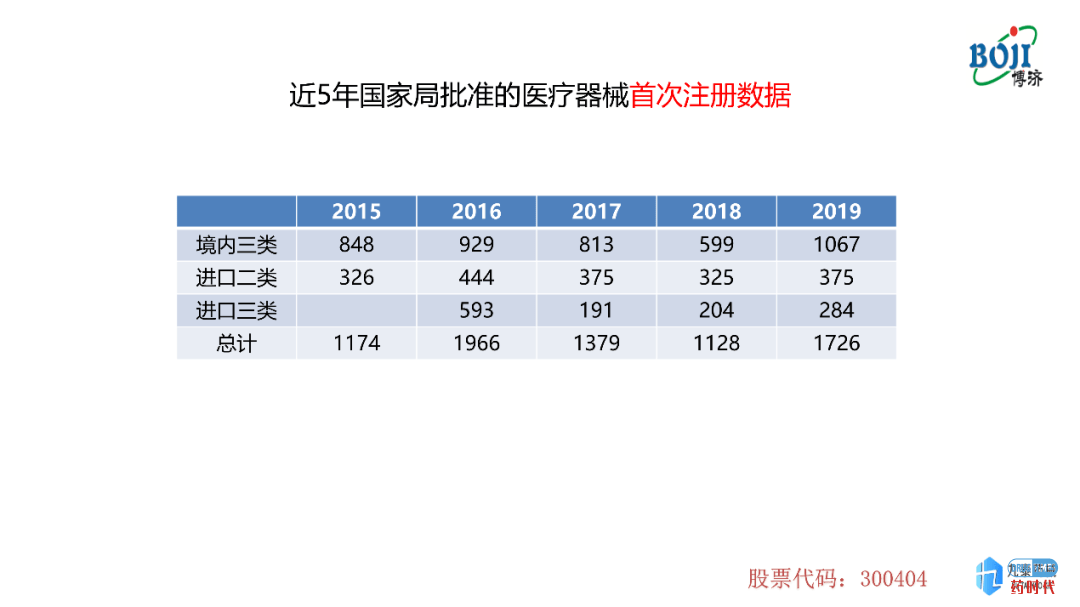
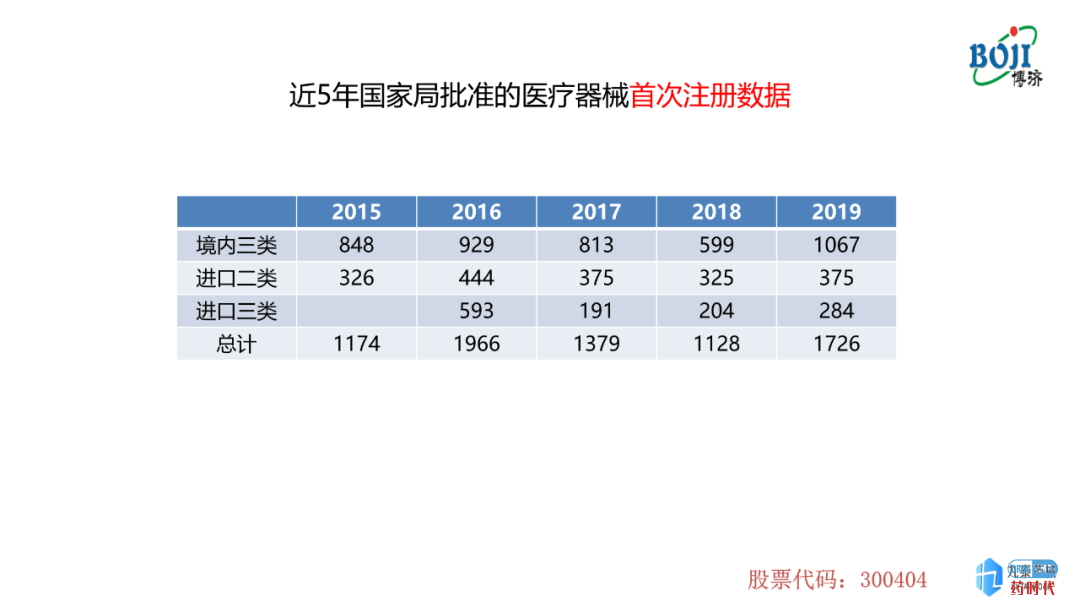
首次注册的数量在2015-2018年呈现下降趋势,但是在2019年达到了一个高峰,包括境内三类、进口二类及进口三类。侧面反映了2019年国家局注册受理数量上升的原因。
-
法规的不同:很多制药公司、药企进军医疗器械行业,他们首先需知道药物的注册、临床试验,特别是药物注册法规和医疗器械注册法规是不一样的。此外临床试验的受理部门也是完全不同的两个部门,一个是国家药品监督管理局医疗器械技术审评中心(以下简称国家器审中心),一个为国家药品监督管理局药品审评中心(以下简称国家药审中心)。
-
市场体量不同:医疗器械的市场体量大约是药品市场体量的1/4左右。
-
上市公司数量相对较少:海内外上市的中国医疗器械公司的数量要远远低过药企的数量,医疗器械公司总量大约为药企的1/8~1/10;
-
学科体系不同:从事制药行业的人员大多为医学或药学相关专业出身,而在医疗器械领域,工科人员则占据了大多数,意大利贵宾会italycasino且学科繁杂;
-
注册难易程度不同:从总体而言,相较于药品,医疗器械注册的难易程度较低,且涉及的费用和时间也相对较少;
-
临床试验从业人员以及注册从业人员:中国从事医疗器械注册的团队或公司大致分3类:(1)以前做咨询公司的、国内的小型民营企业;(2)曾在大型医疗器械企业里长期担任RA职位的一些人,以及他们所组建的团队;(3)外企独立出的注册部门以及子公司。第三类公司的体系较好,但总体而言,医疗器械的从业人员、注册人员要远远少过药品相关从业人员,且专业较为繁杂。
-
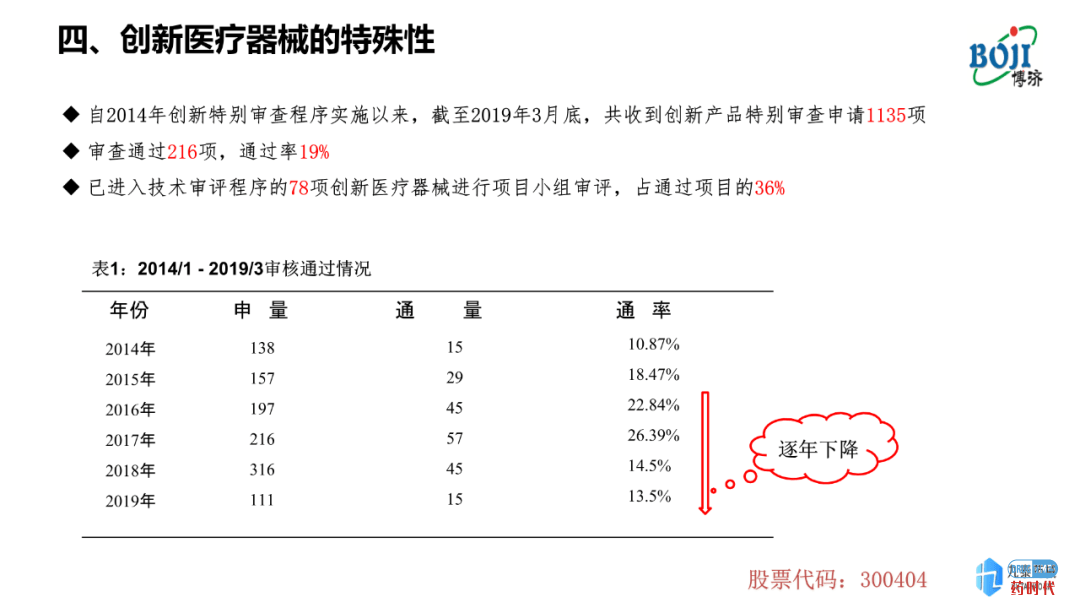
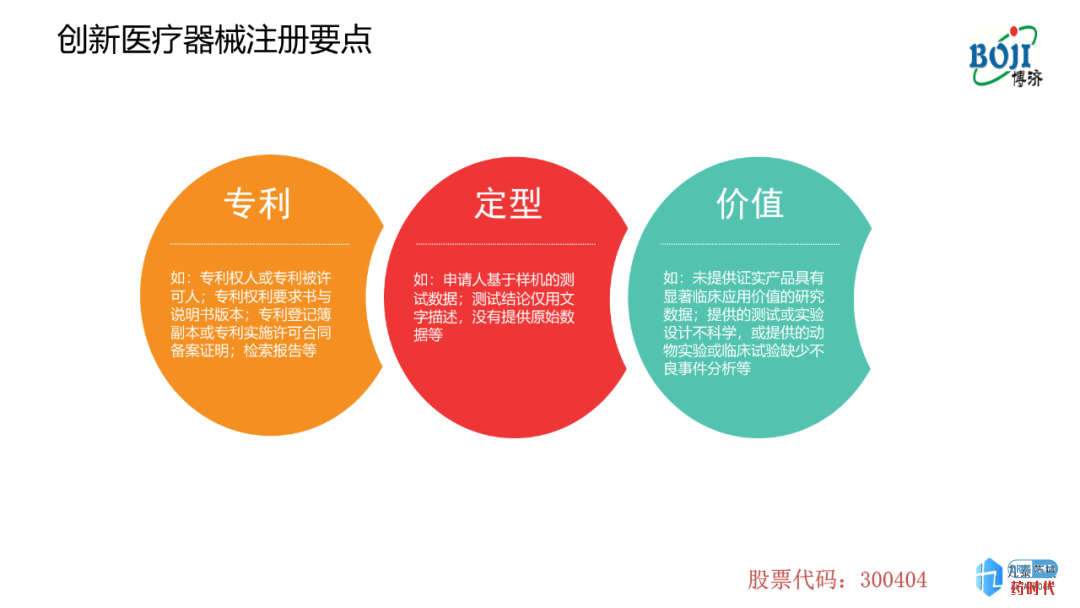
创新类别及数量;医疗器械的创新分很多等级,一种为Ⅲ类、国家公示、审评审批的创新医疗器械;一种为省级鼓励的、Ⅱ类创新医疗器械,对于这一类器械,省级机构会公布一定标准以及相关鼓励政策。但药品创新的难度要远远高于医疗器械。
对于普通从业人员而言,医疗器械的临床试验分为两类,第1类是注册的临床试验,第2类是上市后的临床试验。目前,中国医疗器械CRO公司做的临床试验大多为注册临床实验。但李强先生预测,随着新的《医疗器械监督管理条例》发布(尚未颁布),这一现象可能会发生改变,上市后的临床试验需求量可能会增多。
李强先生在直播中分享道,医疗器械临床实验的申办方对临床试验的成败或承办经费方面应负主要责任,此外CRO、PI以及统计也负有一定责任。
统计:目前在医疗器械领域中,从事或者专注于医疗器械的统计学专家并不多,李强先生期望有更多的热爱医疗器械临床试验的统计学专家或者药物统计学专家关注到医疗器械临床试验行业。
CRO:医疗器械CRO公司分为以下几类。第一类:药物CRO公司分设医疗器械临床试验分公司或部门;第二类:海外医疗器械第三方服务公司到中国设分司,或创业;第三类:大型医疗器械企业或上市公司把内部RA和临床部门独立成为CRO公司;第四类:传统的以办证为主中国本土医疗器械咨询公司在2012年以后,讯速扩张为以临床试验或研发为主的CRO;第五类:中国本土近年兴起的创业型CRO公司。
PI:PI对医疗器械临床试验的热烈程度远不如药物,原因可能如下:
(1)医疗器械多为仿制,创新度较低,PI的兴趣较低;
(2)医疗器械临床试验相关费用较低。
但就责任主体而言,一个医疗器械临床试验,它的最大受益方是申办方,意大利贵宾会italycasino它的申办主体一定是生产方,但是实际上临床试验这个动作是由谁完成呢?一定是由PI去完成。但是设计、执行临床试验方案的时候,一定是由CRO公司、PI、统计团队等多方合作、共同完成的,所以临床试验的责任主体应是多方合作的。
1、注册指导原则:优先前往国家器审中心,查阅该类产品有无注册指导原则。按照注册的原则,临床试验的大方向就没有错误。
2、行业标准原则:由于部分产品没有注册指导原则,但是可参考相关的行业标准,它对临床试验的设计以及产品注册可能会有参考意义。
3、行业合规原则:由于市场上或者是行业里,某一类产品的临床试验负面的东西比较多,在进行临床实验设计以及进行临床试验时,应当规避这些负面的问题.
4、科学专业原则:按照国家颁布的指导原则以及《医疗器械质量管理规范》等即可。
(1)临床意义;(2)临床经济学意义;(3)统计学意义。
目前,多数医疗器械临床试验方案设计的时候,过多地注重了统计学的意义,而对临床意义和临床经济学意义没有那么多的评价指标,特别是临床经济学意义。当一个临床试验的统计学意义和临床意义发生矛盾的时候,我们应该以临床意义为主的。一个好的临床试验,它的临床意义应该为阳性,临床经济学意义是阳性的,统计学意义也是阳性的。如果我们片面地追求统计学意义,会造成很多的误区以及没有临床意义的结果。
曾有人提及抛弃p值,选用AR值、OR值、NT值,以及其他经济学意义指标,全面地评价一个医疗器械临床试验中这三个方面的意义。李强先生认为随着《医疗器械临床评价技术指导原则》颁布之后,医疗器械临床试验方案设计方面就加进了很多临床流行病学,这将会兼顾并完善医疗器械临床试验的三个意义。
为什么强调这三个意义?因为中国有一些人的统计学背景,并非预防医学而是数理统计。如果片面地强调统计学意义,可能会造成申办方对统计学有一个非常大的恐惧。所以李强先生认为这三个方面意义应当是均衡和相互制约的。
平行:目前对已经上市的、有同类产品的医疗器械临床试验(多数是诊断产品),意大利贵宾会italycasino多数采取平行对照设计。为什么要做平行呢?因为有些疾病的发生、发展与季节温度、疾病的诊断的标准有关。所以平行就意味着同期,以及对病人的诊断方法必须是一致的。
沾染与干扰:沾染与干扰大多出现在非住院患者,这就对一个研究者或研究护士、CRC或者CRO的要求很高。此外,沾染与干扰也取决于器械的设计以及受试者的生活习惯。如果器械不便利以及受试者有喝中药等习惯,均会造成沾染与干扰。
配对设计:所有体外诊断试剂、检测类医疗器械的临床试验都要配对。
交叉设计:总而言之,就是慢性病自身前后两个阶段的对照,比如一组病人,第1阶段用a方法治疗,在经过洗脱期之后开始第2个阶段再用a法做治疗配对,需注意的是交叉设计一定是针对慢性病,因为慢性病病情不会随着时间的变化,变化很大。
单组设计:中国的单独设计和美国FDA中单独设计所使用的范围是略有不一样的。
关于样本量预测的影响因素,李强先生推荐了《临床研究样本量预测》一书。而影响样本量的因素包括以下PPT中提及的:
-
设计类型;设计类型的不同,样本量预测的公式也不同;
-
评价指标:可寻求统计学人员的帮助,设计一个公式,通过文献等找出对应的率、均数、临床界值等,计算对应的样本量;此外,李强先生还提及,率的取值会对样本量有很大的影响,需要查阅权威文献或咨询相关专家;
-
临床意义的界值:需要PI团队的认可,以避免样本量过低等不规范情况;
-
假阳性和假阴性错误的概率:α值大多与主要评价指标的数量、单双侧试验等有关,可与专业的统计人员沟通;
-
核心文献的选取:李强先生建议可通过学习《临床流行病学》、《医学文献学》以及《医学文献检索》三门课程,会对这方面有较为全面的了解;
-
脱落率:脱落率与受试者的依从性、CRO公司临床试验管理团队等有一定的关系。
以做创新医疗器械的经验而言,单独目标值是做创新医疗器械的一个比较主要的方法。
但在制定单独目标值时,首先确定美国FDA方面是否有先例,以及FDA对单独目标值的要求;其次,查阅国内创新医疗器械企业在单独目标值方面出现过的问题,以避免类似的问题;第三,由于单独目标值均为历史对照,而历史对照都是临床研究方法学中论证力度较低的方法,因此李强先生建议慎用单独目标值。
李强先生在直播中强调,国内很多申办方不注重方案讨论会这一点,常常会出现递交伦理审查之后再与第三方公司讨论方案,这其实是时间逻辑上的错误。此外,李强先生在直播中表明,与研究者、研究中心的专家有效沟通合作有助于最后注册答辩。
有效的沟通合作是在相互尊重企业文化、规章制度等基础上建立的。每个企业均有自己独特的企业文化,相互尊重可为合作奠定一个良好的基础。此外,试验申办方等需考虑机构办专家工作的复杂性以及临床试验是否会给医生带去不良影响,做到相互体谅、共同合作。除去以上这些,试验申办方等需要着重考虑伦理问题,保障试验中受试者的合法权益。意大利贵宾会italycasino
1、方案制定过程的特殊性:需密切跟踪国家器审中心对该医疗器械临床试验的讨论以及颁布的指导原则;
2、方案设计的特殊性:方案中会涉及单组设计;
3、统计方合作的特殊性;选择一个权威的专家以及一个合作性高的的统计团队,以避免沟通时不必要的争论;
5、多方事务沟通以及重大节点的对外宣布:任何事务的对外宣布,需征得申办方的许可;



















欢迎朋友们走进“药时代直播间”!秉持“聚焦新药研发,荟萃行业精华,分享交流合作,共筑健康天下!”这一宗旨和目标,2020年药时代将推出一系列优质的直播课程,邀请行业专家就新药研发相关的焦点话题做精彩的解读和分享,帮助朋友们学习新知识,掌握新技能,结交新朋友。衷心感谢朋友们长期以来的支持、惠助!我们将竭尽全力,持续不断地为朋友们带来优质、有价值、高品质的内容!

发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权



























 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
