

点击阅读原文
头颈部鳞状细胞癌(HNSCC)是一种常见的癌症,占据了超过90%的头颈部肿瘤,HNSCC五年生存率低,且预后较差。近十年来,HNSCC发布率明显升高,尤其是在女性中。HNSCC除了给患者带来严重的生理伤害,还会对患者造成心理伤害。
基于PD-1的免疫检查点抑制剂和化疗药物的联合疗法已被批准用于复发性或转移性头颈部鳞状细胞癌(HNSCC)的一线治疗。并已显著改变了HNSCC的治疗前景。
但是,患者对该联合疗法的客观应答率不是很高,中位应答持续时间相对较短,这表明HNSCC可能对PD-1阻断具有内在抵抗力,并最终导致治疗后的复发。
越来越多的证据表明,CSC可能分泌各种生长因子和细胞因子来抑制免疫反应并促进免疫抑制性肿瘤微环境。例如最近有研究发现,CSC通过表达CD80直接抑制细胞毒性T细胞活性并介导肿瘤对T细胞免疫疗法的抗性。
这些研究表明,靶向CSC对于提高免疫疗法的疗效和预防肿瘤复发可能至关重要。
近日,中国工程院外籍院士,加州大学洛杉矶分校王存玉团队在 Cell Stem Cell 杂志发表了题为:BMI1 Inhibition Eliminates Residual Cancer Stem Cells after PD1 Blockade and Activates Antitumor Immunity to Prevent Metastasis and Relapse 的研究论文。
该研究证实BMI1阳性CSC负责HNSCC的起始、侵袭性生长和转移。靶向BMI1阳性CSC与化疗药物顺铂联用,可协同抑制HNSCC的生长,从而表明联合治疗肿瘤主体和清除CSC可以达到更好的癌症治疗效果。
此外,该研究还发现,BMI1的药理或遗传抑制,不仅有助于清除BMI1阳性CSC,还会通过激活肿瘤细胞内在免疫力来增强PD-1阻断作用,从而抑制了转移性肿瘤的生长并防止了肿瘤复发。
这些临床前研究为开发基于PD-1抑制剂与BMI1抑制剂联合治疗的新临床试验奠定了重要基础。

癌症干细胞(CSC),也称为癌症起始细胞,与肿瘤的起始,生长和转移有关。越来越多的证据表明,CSC可能与癌症治疗的耐药性以及复发有关。因此,为了实现肿瘤的完全消退,必须靶向并清除CSC。
已有研究表明 BMI1 控制癌症干细胞(CSC)自我更新,并在几种人类癌症中发挥作用,其中包括头颈部鳞状细胞癌(HNSCC)。
用小分子抑制剂PTC209靶向BMI1可以消除异种移植裸鼠模型中从人结肠直肠癌中分离的CSC的自我更新。在原位肿瘤小鼠模型中使用体内谱系追踪,有说服力地证明BMI1阳性CSC负责HNSCC的起始、侵袭性生长和转移。
靶向BMI1阳性CSC与化疗药物顺铂协同抑制HNSCC的生长,从而表明联合治疗肿瘤主体和清除CSC可以达到更好的癌症治疗效果。
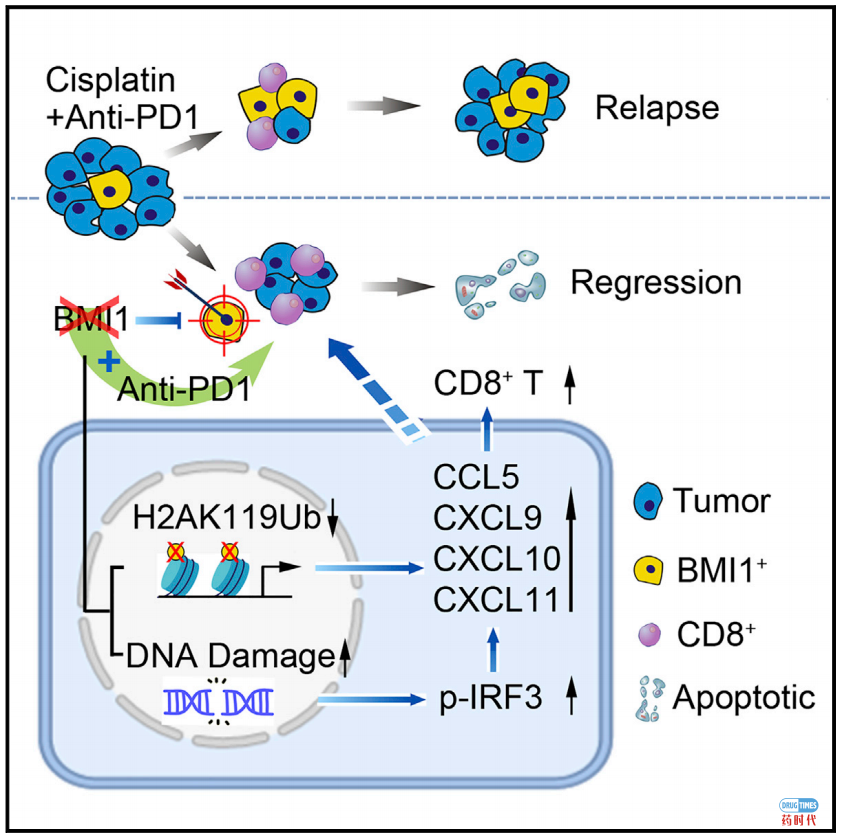
从机制上来说,这些肿瘤细胞中的BMI1抑制,会激活其免疫反应并募集CD8+T细胞。因此靶向BMI1,除了清除CSC外,还可以通过募集CD8+T细胞来使非干性肿瘤细胞对抗PD-1抗体敏感。
PD-1阻断和BMI1抑制的结合不仅抑制了转移性HNSCC的生长,而且有效地阻止了HNSCC的复发。
PTC596是PTC209的类似物,已经在临床试验中用于治疗晚期实体瘤。1期临床试验表明患者对PTC596耐受性良好,并具有可控的胃肠道副作用。
接下来,研究团队将进行一项临床试验以确定PD-1抑制剂和PTC596是否协同抑制人HNSCC的生长和淋巴结转移。
总的来说,这项研究通过靶向CSC和激活肿瘤细胞内在免疫应答,对开发针对晚期癌症的新型联合治疗方法具有重要意义。
论文链接:
版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
我国原创治疗阿尔茨海默病新药正式上市,九期一®国际多中心临床研究计划发布
Science | 阿尔茨海默病专家们以期待和谨慎的心情迎接中国令人惊奇地批准一个治疗脑疾病的新药



本文转载自药研网,本文观点不代表药时代DrugTimes立场。

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
