

免疫检查点抑制剂,包括CTLA-4、PD-1和PD-L1等的阻断抗体,在癌症患者中显示出抗肿瘤活性,已被批准用于许多实体瘤治疗,包括晚期黑素瘤、非小细胞肺癌肾细胞癌和膀胱癌等。
免疫检查点疗法很大程度上改变了癌症治疗格局,但由于多种因素,仍有很大一部分患者对这些疗法没有反应。因此,需要探索免疫检查点疗法与其他药物联用的治疗方案,以提高癌症治疗效果。
与PD-1、CTLA4等抑制性免疫检查点不同,CD40、CD27、OX40等属于共刺激性检查点,针对共刺激性检查点的激动性抗体药物近年来受到越来越多的关注。
靶向免疫细胞上激活受体的激动性免疫刺激抗体(IS-Abs)是免疫检查点抑制剂的潜在替代品,并已在临床前模型中显示出显著效果。
激动性抗CD40单抗能够通过激活树突状细胞(DC)来增强T细胞反应的启动能力。因此,抗CD40抗体可将“冷肿瘤”变成“热肿瘤”。此外,发现抗CD40抗体通过修饰肿瘤中的免疫抑制性髓细胞浸润而使肿瘤对免疫反应的容忍度更高。
考虑到抗CD40单抗的树突状细胞(DC)激活能力,这些单抗的临床前和临床试验主要集中于与细胞生长抑制药物的组合。
近日,Nature 子刊 Nature Communications 杂志发表了一项题为:Proimmunogenic impact of MEK inhibition synergizes with agonist anti-CD40 immunostimulatory antibodies in tumor therapy 的研究论文。
该研究表明,激动性抗CD40单抗与MEK抑制剂的组合用药可产生更好的治疗效果,MEK抑制剂对肿瘤细胞何肿瘤微环境的强大的抗肿瘤细胞毒性作用,与激动性抗CD40单抗的免疫刺激作用互补,从而产生了更好的效果。

胰腺导管腺癌(PDA)的肿瘤生长的主要驱动力是KRAS基因突变,是的肿瘤高度依赖MAPK/MEK通路。然而,胰腺导管腺癌(PDA)对药理性MEK抑制的临床反应令人失望。
在临床上应用临床相关剂量的MEK抑制剂可有效诱导突变型KRAS驱动的胰腺导管腺癌(PDA)肿瘤消退,但不会损害体内T细胞启动,克隆形成和效应器功能。此外,MEKi对TME中的几个免疫抑制亚群有抑制作用,特别是CD4+T调节细胞,M2型巨噬细胞和MDSC。
重要的是,这些作用不是MEKi诱导的肿瘤细胞死亡的间接作用,因为在B16-OVA和MC-38肿瘤的MEKi单药治疗期间也观察到了这些作用,而对肿瘤生长的影响可以忽略不计。
体外实验进一步证明了这种药物影响的直接性质,即与M1型巨噬细胞相比,MDSC和M2型巨噬细胞对MEK抑制的敏感性更高。这些发现与MEK通路在髓样细胞亚群中的不同作用有关。
在这方面,抗CD40抗体的作用是高度互补的,因为它增强了树突状细胞的抗原呈递,从而间接刺激了CD8+T细胞,并促进了M1样巨噬细胞。由于这种互补的药物作用,MEK抑制剂/抗CD40单抗组合发挥了协同抗肿瘤功效。
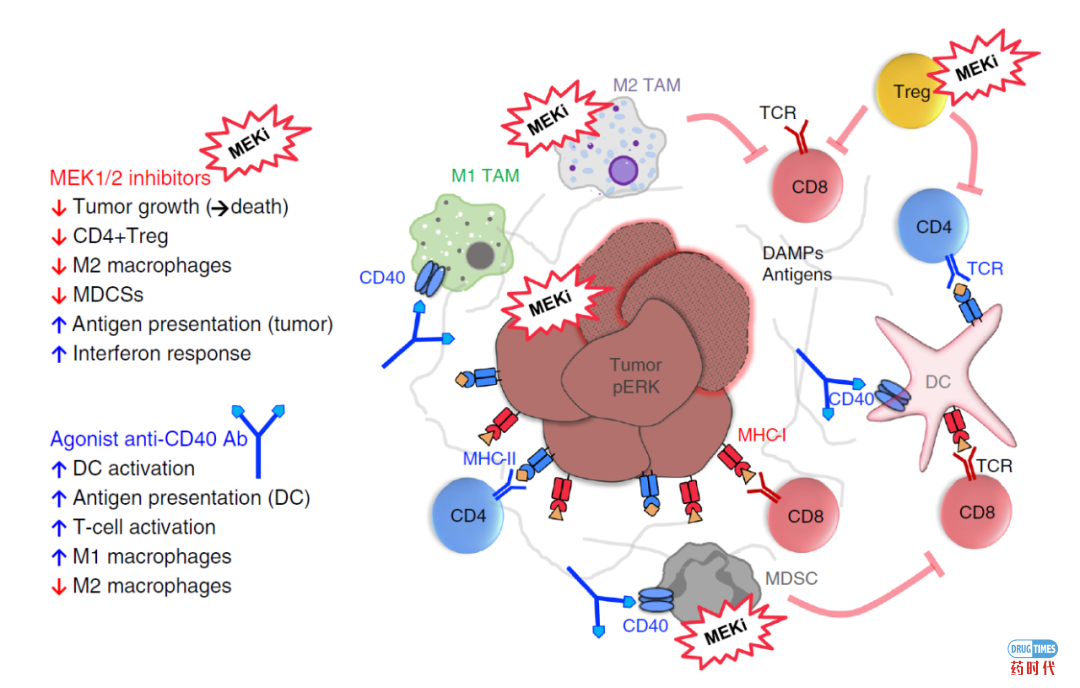
总的来说,MEK抑制剂和激动性抗CD40单抗的组合是治疗肿瘤的高效方案,特别是对于KRAS突变驱动且髓样细胞大量浸润的癌症,例如胰腺导管腺癌(PDA)等癌症。
通过将MEK抑制与免疫效应机制的CD40下游激活相结合,可以克服MEK抑制剂单独用药或与化疗药物联合使用时疗效局限性。
根据胰腺导管腺癌(PDA)动物模型中的实验数据,激动性抗CD40单抗比抗PD-1单抗更有效,此外,CD40激活与靶向MEK抑制的联合治疗优于与化疗联合治疗。
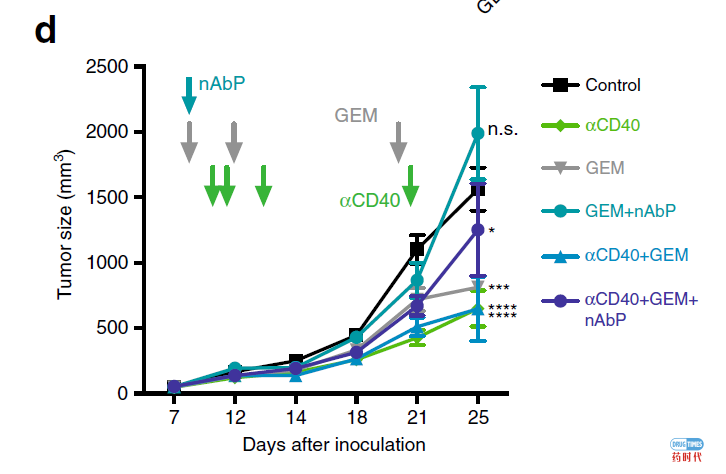
尽管已经在包括胰腺癌在内的集中癌症中开展了激动性CD40单抗作为单一药物以及与化疗药物联合治疗的临床试验,但仍缺乏有效治疗窗口的证据。
这项研究为探索MEK抑制剂/激动性抗CD40单抗组合在突变KRAS驱动的肿瘤(例如胰腺癌)中的治疗提供了依据。
论文链接:
版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
c-Met抑制剂进入收获期:2款里程碑药物获批上市,国内数十药物临床进行中!
60亿美元大单再掀ADC风潮,国内公司能否在巨头环伺中乘风破浪?



本文转载自药研网,本文观点不代表药时代DrugTimes立场。

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
