
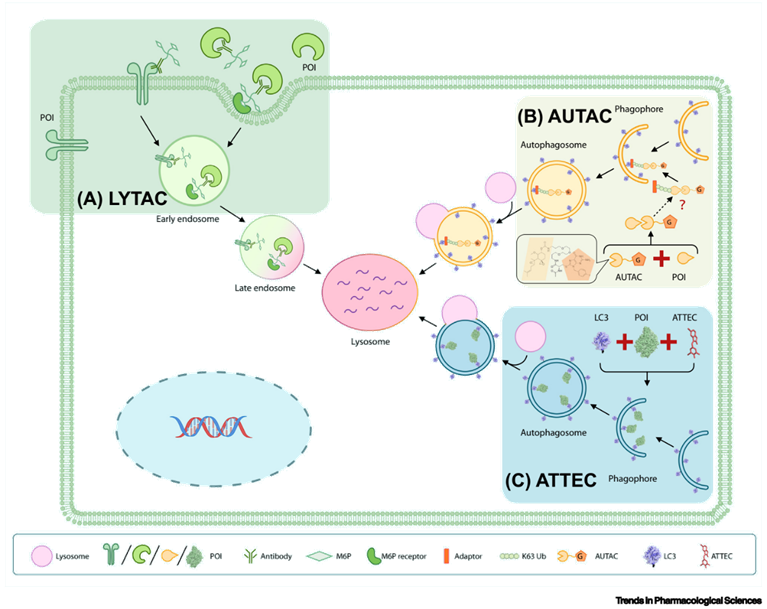
(lysosome-targeting chimaera)
LYTAC技术的特色是其可以靶向降解定位于细胞膜外或者细胞膜上的蛋白。
2020年6月29日,Nature杂志在线发表了斯坦福大学Howard Hughes Medical Institute的Carolyn R.Bertozzi教授课题组一篇名为《Lysosome-targeting chimaeras fordegradation of extracellular proteins》的研究论文,提出了一种蛋白靶向降解技术LYTACs。

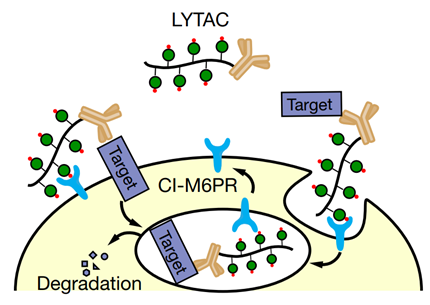
LYTAC技术利用溶酶体途径实现蛋白的靶向降解。与泛素化蛋白降解系统类似,溶酶体途径也是细胞内回收蛋白的重要方式。CI-M6PR是一个多结构域跨膜糖蛋白,主要定位于细胞膜上和高尔基体膜上,它介导了溶酶体酶的分选和转运过程。例如,新合成的溶酶体水解酶会被6磷酸甘露糖(M6P)残基修饰,修饰后的M6P残基会被CI-M6PR识别并转运至溶酶体。除了溶酶体酶外,CI-M6PR还能够介导其它被M6P修饰的蛋白转运至溶酶体降解的过程。由于CI-M6PR在细胞膜上大量分布,那么我们有理由相信,如果设计一个分子将CI-M6PR与靶蛋白连接到一起,那么CI-M6PR可能会将靶蛋白转运至溶酶体中并降解。根据上述原理,研究人员设计了如下模式的LYTAC分子:
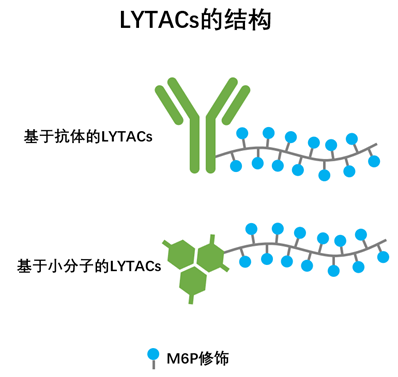
LYTAC分子一端为特异性结合靶蛋白的抗体或小分子,另一端为连接着多个M6P基团的长链。当抗体或小分子与细胞膜外或细胞膜上的靶蛋白结合后,M6P基团会被CI-M6PR识别,CI-M6PR会将自身结合的蛋白转运至溶酶体进而完成蛋白的降解过程。
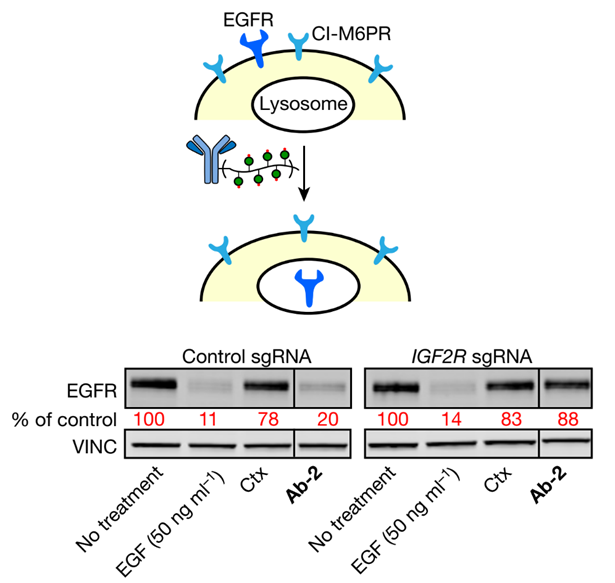
该研究对EGFR、PD-L1、CD71等细胞膜表面的热门靶点进行了验证。结果显示,经过合理设计的LYTAC分子能够迅速降解上述膜蛋白。
(autophagy-targeting chimera)
本小节的AUTAC与下一小节中将要介绍的ATTEC技术均为基于细胞自噬途径开发的靶向降解技术。
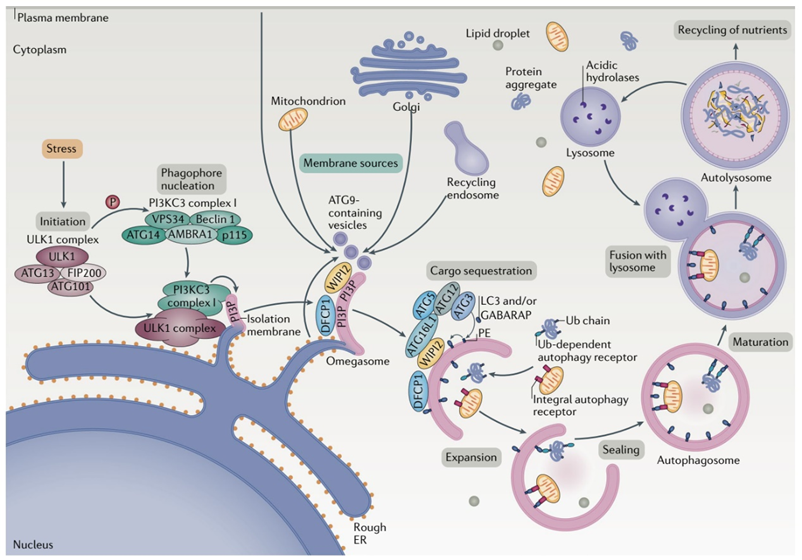
自噬本是细胞为了应对能量或营养物质短缺而产生的一种应激反应。当细胞处于饥饿环境或受到损伤时,损伤的细胞器碎片、错误折叠的蛋白质等物质会被包裹在自噬体(autophagosome)中进入自噬途径。在自噬的最后阶段,自噬体会与溶酶体融合,自噬体的内容物也会随之被溶酶体内的各种酶类降解为氨基酸等基础分子。由于自噬途径在多种生理和病理条件下的重要功能,目前已有多种靶向自噬途径的药物处在研发当中,但这些药物通常缺乏选择性。
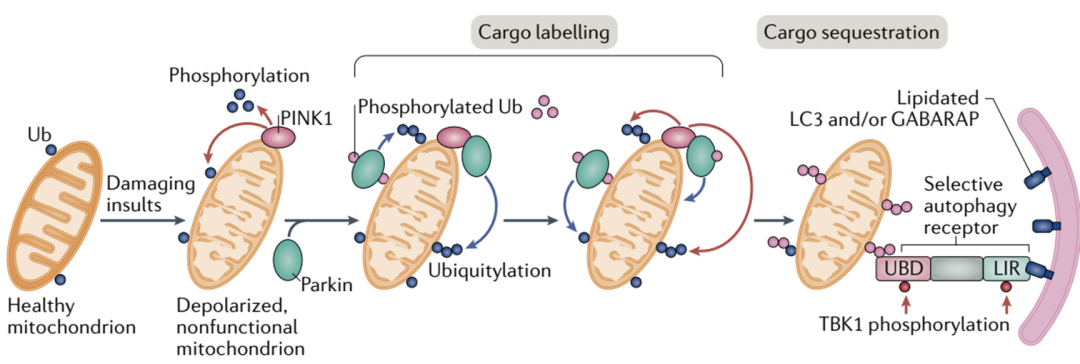
很长一段时间以来,细胞自噬被认为是一个缺乏选择性的过程。但近年来的研究表明,除了无选择性的自噬以外,同样存在一种选择性的自噬过程。与具备高度选择性的泛素化-蛋白酶体降解途径类似,选择性自噬同样需要对靶标事先进行泛素化标记(此处需要注意,泛素化-蛋白酶体途径的泛素化修饰为K48位点连接的多泛素化修饰,而自噬过程需要的泛素化修饰则是通过K63位点相连接)。K63泛素化修饰是一种自噬途径的“eat-me”的信号,该修饰会被自噬受体(autophagy receptor)识别,而自噬受体则通过其LC3-interactingregion与自噬体膜上的LC3蛋白相连接,从而将靶标转运至自噬体中并完成后续降解过程(注意下图中自噬体上的蓝色小颗粒,即为LC3)。与依赖泛素化-蛋白酶体途径的PROTAC技术相比,自噬体途径的优势不言而喻:自噬体能够降解大规模聚积的变性蛋白(这在很多神经退行性疾病中常常见到),甚至能够清除整个受损伤的细胞器(只要自噬体装得下),而PROTAC则只能降解那些在细胞质基质中“可溶”的蛋白。

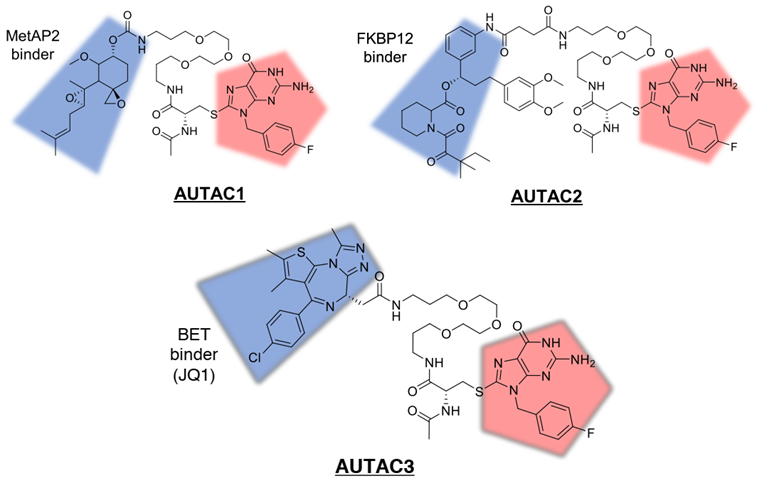
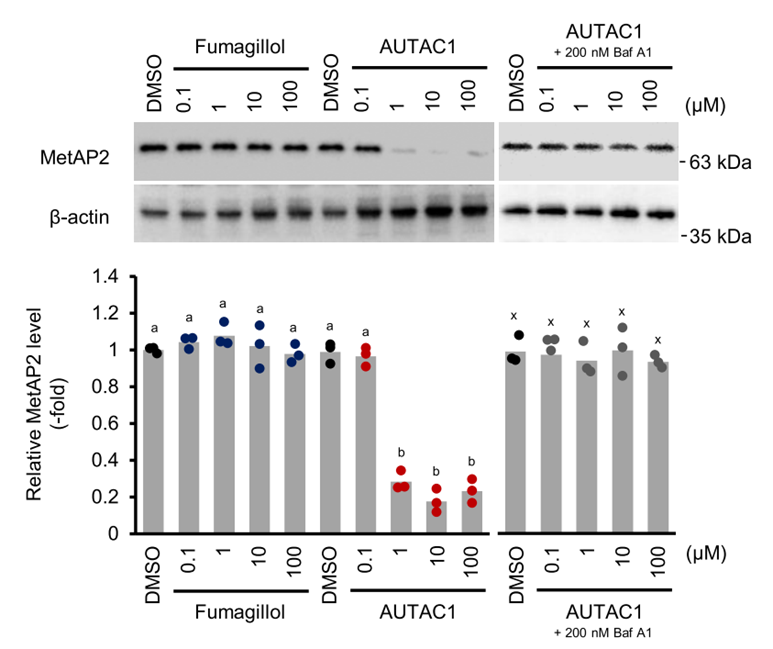
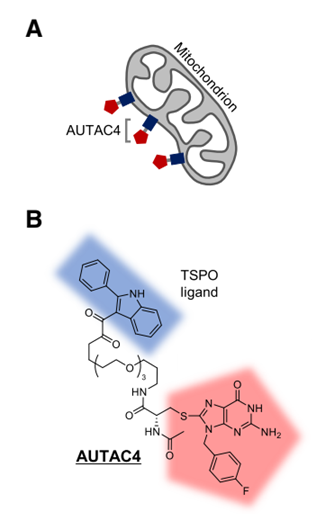
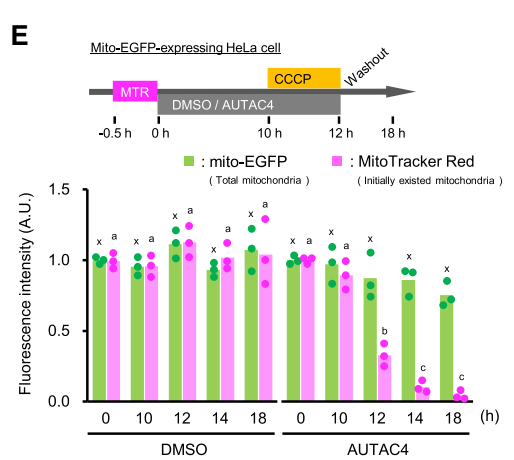
(autophagosome-tethering compound)
第三项技术ATTEC由复旦大学生科院鲁伯埙教授于2019年首次发表在Nature杂志上。在这项研究中,鲁伯埙教授在细胞水平和亨廷顿病(HD)动物模型上对ATTEC的疗效进行了验证。与AUTAC类似,本小节所介绍的ATTEC技术同样基于细胞自噬途径开发,但二者分子类型有所不同。AUTAC分子采用的是类似PROTAC的“两端靶向小分子+中间linker”的模式,而ATTEC分子则采用了“分子胶”的原理,不需要linker的介入。

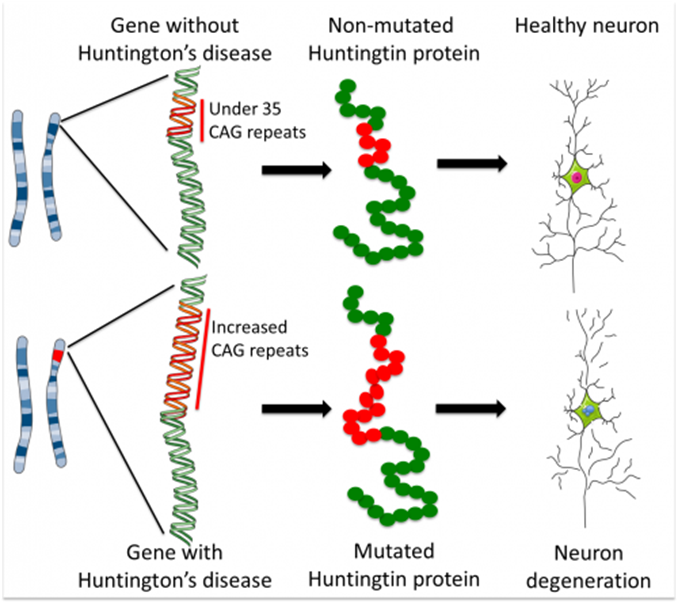
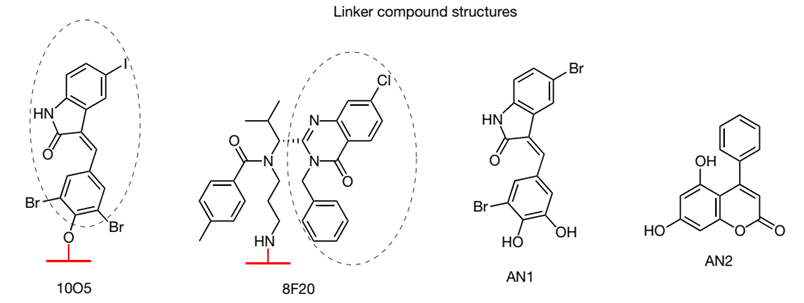
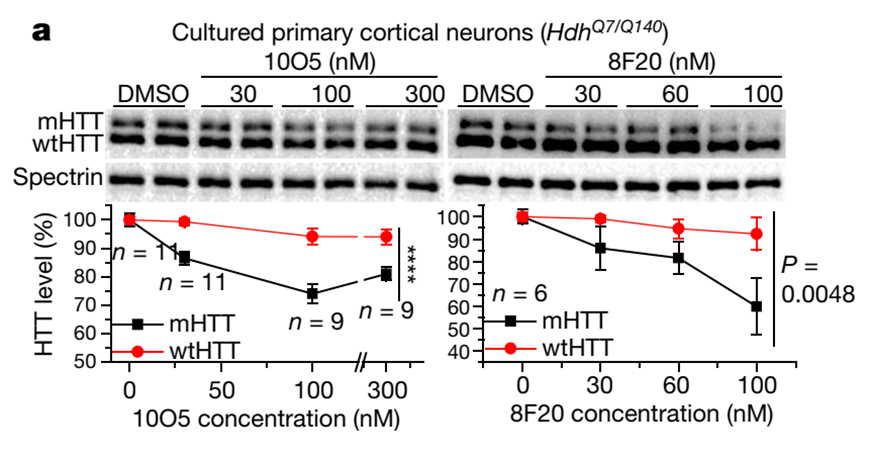
细胞水平的实验表明,上述小分子能够有效地降解突变型HTT蛋白,而对野生型HTT蛋白的水平没有影响。
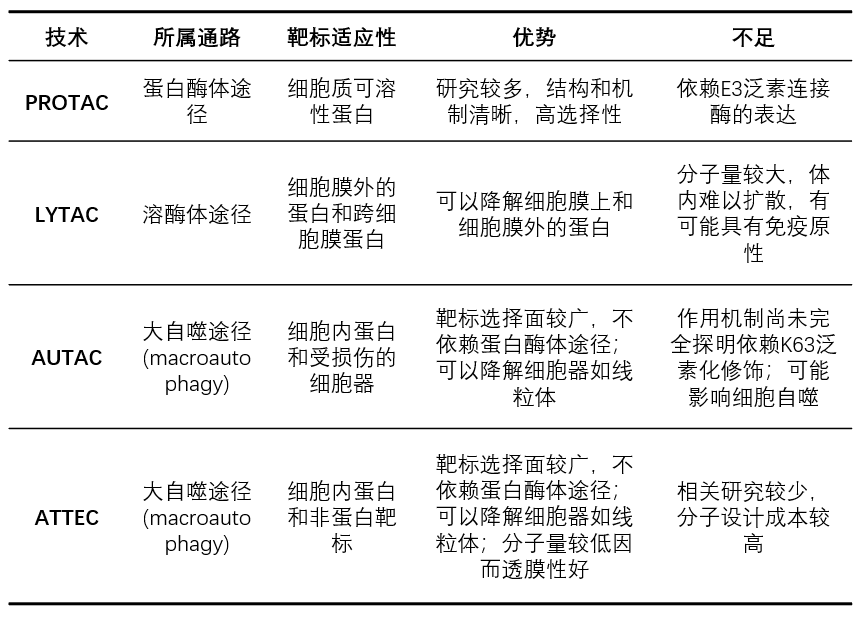
最后,作为总结,让我们再来回顾一下PROTAC与本文中介绍的LYTAC、AUTAC、ATTEC等三种技术的优势与不足:
参考文献
3、Djajadikerta A, Keshri S, Pavel M, et al. Autophagy induction as a therapeutic strategy for neurodegenerative diseases[J]. Journal of Molecular Biology, 2020, 432(8): 2799-2821.
4、Li Z, Zhu C, Ding Y, et al. ATTEC: a potential new approach to target proteinopathies[J]. Autophagy, 2020, 16(1): 185-187.
5、Ding Y, Fei Y, Lu B. Emerging New Concepts of Degrader Technologies[J]. Trends in Pharmacological Sciences, 2020.
6、Dikic I, Elazar Z. Mechanism and medical implications of mammalian autophagy[J]. Nature reviews Molecular cell biology, 2018, 19(6):349-364.
7、Bates G P, Dorsey R, Gusella J F, et al. Huntington disease[J]. Nature reviews Disease primers, 2015, 1(1): 1-21.
免责声明
内容仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。版权归作者。衷心感谢!
本文为转载,药时代持中立态度,请理性阅读
版权声明:文中图片取自网络,根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。衷心感谢!
药时代专访 | 不用病毒?定点整合?CRISPR加持下的新CART背后有什么有趣的故事? 大型药企收购、AMR行动基金成立等行动能否帮助抗生素研发管线摆脱窘境,填补空白? FoundationOne CDX测试获FDA批准,NTRK融合肿瘤患者将精准受益


 关注药时代,共创新未来!
关注药时代,共创新未来!
发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权

 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
