DrugTimes, We Help You Find Partners in China!
伏立诺他(vorinostat)是一种组蛋白去乙酰化酶(histone deacetylase, HDAC)抑制剂,通过干扰去乙酰化酶的活性达到治疗目的。2006年10月6日美国FDA批准伏立诺他上市用于治疗皮肤T细胞淋巴瘤(cutaneous T-cell lymphoma, CTCL)。
伏立诺他的研发始于科研人员偶然发现二甲基亚砜(dimethyl sulfoxide, DMSO)具有诱导白血病细胞分化的作用。科研人员从DMSO这个最简单的分子开始,通过大胆假设和科学求证,最终成功研发出了第一个HDAC抑制剂。
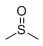
图1. DMSO
随后Breslow课题组对DMSO进行了相应的构效关系研究,并从DMSO扩展到与其类似的极性化合物,研究发现以下化合物1-12均具有DMSO诱导MELC分化的类似作用。
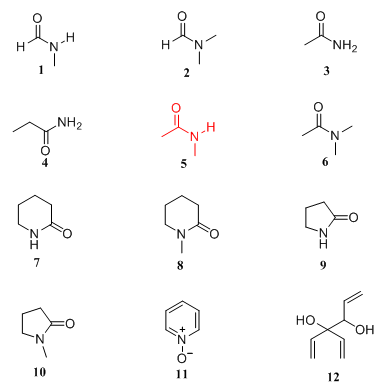
图2. 极性化合物1-12
科学家假设,细胞在合成DNA时,这类极性化合物可能改变了DNA或DNA-蛋白质复合物的构象,从而致使细胞在传染及分化过程中发生改变。
为了进一步提高化合物的诱导活性,研究者以化合物5为起始物,设计并合成了一系列化合物5的二聚化物,欲通过增加化合物的极性基团以增加其与未知标靶的结合能力。活性测定结果显示,最简单的双酰基乙二胺13的活性并未强于化合物5,但是当二聚物之间的链长增加到5-8时,其活性则显著增强,且在低浓度下亦有较高的诱导活性。然而当链长为7-8时,其有明显的细胞毒活性,而当链长为5-6时既有较高的诱导活性且不产生细胞毒活性,且六亚甲基双乙酰胺14(hexamethylene bisacetamide, HMBA)有最高的诱导活性。后期筛选发现,化合物14为活性和毒性之间有显著区分的优选分子,为第一个里程碑式的化合物。
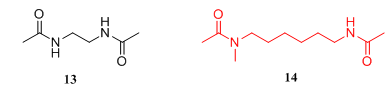
图3.化合物13和14
虽然对双酰胺类化合物诱导细胞分化的作用靶标仍不明确,但是前期研究已经证明,两个酰胺基团是化合物的优化结构。所以研究者进一步猜测,这两个酰胺基团可能通过与金属离子螯合或形成氢键而起药理活性的作用,故研究者利用异羟肟酸片段来替换酰胺基以进一步增强化合物与金属的螯合力或增加氢键结合的机会,因此合成了一系列双异羟肟酸化合物。考察了柔性连接基、刚柔并济的连接基以及刚性连接基对活性的影响。
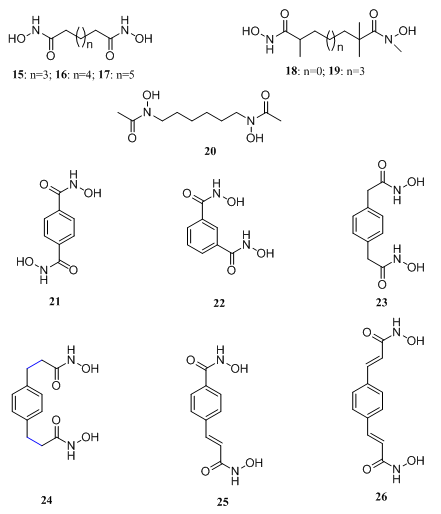
图4. 双异羟肟酸类化合物
(2) 连接基庚二酸和壬二酸的双异羟肟酸(分别为15和17)的活性较化合物16低,且将连接基缩短后活性更低;
(3) 在酰基的α位引入甲基(如化合物18和19)后活性消失,这可能与位阻有关;
(4) 对甲苯二异羟肟酸21的活性与化合物16的活性相当,而间苯二异羟肟酸22则无活性,单个或三个异羟肟酸亦无活性;
(5) 在化合物21的基础上各嵌入一个亚甲基得到的化合物23则活性消失,但各嵌入两个亚甲基后的化合物24活性恢复,但是若引入双键则化合物25和26活性显著增强。
微小的结构变动引起活性的剧烈变化,提示化合物与靶标结合的精准性与复杂性。研究者进一步筛选了活性较强的衍生物对HL-60和HT-29细胞的诱导分化活性,结果表明,化合物16的活性最好。
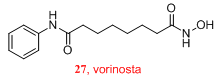
图5. 伏立诺他
伏立诺他的问世可以说创造了奇迹,它是在靶标及作用机制均不清楚的情况下,完全依靠最传统的构效关系研究,经过一步步的摸索最终上市。

DrugTimes, We Help You Find Partners in China!

 点击直达,了解更多精彩内容!
点击直达,了解更多精彩内容!发布者:药时代,转载请首先联系contact@drugtimes.cn获得授权



 为好文打赏 支持药时代 共创新未来!
为好文打赏 支持药时代 共创新未来! 
